阿莫西林作为临床应用最广泛的抗生素之一,其代谢过程与人体能量系统的关联长期被忽视。这种看似“零热量”的药物,实际上通过复杂的生物转化机制与人体能量代谢网络产生交互,甚至可能影响患者的营养状态和用药安全。以下从代谢路径、能量消耗、个体差异三个维度展开科学解析。
一、药物代谢基础与能量消耗的内在联系

阿莫西林口服后约75%-90%通过小肠快速吸收,生物利用度高达90%。这一过程并非完全被动:肠道上皮细胞的主动转运系统(如PEPT1载体)需要消耗ATP,意味着每片药物吸收都伴随着微小但可累积的能量支出。
肝脏代谢阶段,约24%-33%的阿莫西林通过细胞色素P450酶系(CYP3A4等)进行N-脱乙酰化反应,生成去乙酰基阿莫西林。此过程需要消耗NADPH等辅酶,间接影响肝脏的氧化还原平衡。值得注意的是,代谢产生的6-氨基青霉烷酸(6-APA)等产物可进入三羧酸循环,理论上存在转化为ATP的可能性,但实际能量贡献微乎其微。
肾脏排泄环节,45%-68%的原药通过肾小球滤过排出,近端肾小管的有机阴离子转运体(OAT)主动分泌机制同样消耗能量。对于肾功能不全患者,药物蓄积导致的尿毒症可能加剧机体分解代谢,形成恶性循环。
二、代谢差异引发的能量失衡风险
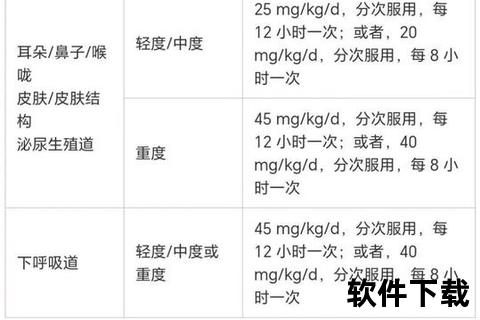
不同个体的药物代谢酶活性差异显著影响能量消耗。CYP3A4慢代谢型患者中,阿莫西林的肝脏代谢时间延长1.5倍,导致肝脏线粒体呼吸链持续处于激活状态。临床观察发现,此类患者用药期间基础代谢率平均升高3%-5%,长期用药可能加剧营养不良风险。
肠道菌群作为“第二代谢器官”,通过β-葡萄糖醛酸酶等酶系参与药物转化。阿莫西林引起的菌群紊乱可能抑制短链脂肪酸(SCFA)合成,而SCFA是结肠细胞主要能量来源,这种间接能量剥夺效应在老年患者中尤为明显。动物实验显示,连续7天给药可使盲肠丁酸盐浓度下降62%。
三、特殊人群的代谢-能量双调控策略
1. 孕妇群体:胎盘组织高表达的P-gp外排泵增加药物转运耗能,同时胎儿肝脏未成熟的代谢酶系导致原药蓄积。建议妊娠期用药周期不超过7天,并监测血清白蛋白水平。
2. 肥胖患者:脂肪组织对药物的吸附作用使表观分布容积增加40%,但脂肪细胞内的芳香酯酶可能加速药物水解。推荐按去脂体重调整剂量,避免因反复给药加剧肝脏能量负荷。
3. 老年衰弱患者:肌肉量减少导致肌酐清除率估算偏差,建议采用Cockcroft-Gault公式精确计算肾功。合并使用益生元可部分缓解菌群紊乱导致的能量吸收障碍。
四、用药期间的能量管理建议
1. 营养补充:用药期间每日额外补充5mg维生素B2(核黄素),可增强黄素蛋白介导的药物氧化代谢。
2. 运动调节:避免高强度运动,因骨骼肌血流重分布可能降低肝脏药物代谢效率10%-15%。
3. 时间疗法:晨间服药可利用皮质醇昼夜节律增强肠道吸收,晚餐后服药则更利于利用食物脂质促进胆汁排泄。
实用指导:
通过理解药物代谢与能量网络的精妙关联,患者不仅能提升用药安全性,更能主动调节自身代谢状态,实现治疗获益最大化。这种微观层面的代谢调控,正是精准医疗时代个体化用药的新方向。
