炎症如同身体发出的求救信号,当关节红肿热痛、皮肤反复溃烂或不明原因的持续发热出现时,往往提示着免疫系统的异常激活。这些症状可能从轻微不适发展为器官损伤,其背后隐藏着复杂的分子机制。最新研究揭示,通过精准干预细胞代谢通路、调节免疫细胞功能等创新手段,人类正逐步突破传统抗炎治疗的局限。
一、炎症失控的深层密码
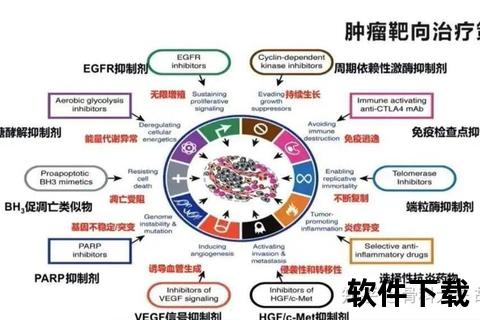
细胞能量工厂的重编程是近年发现的炎症关键机制。中山大学团队发现,Pim2激酶会促使巨噬细胞从高效产能的氧化磷酸化转向低效的糖酵解模式,这种代谢转换导致促炎因子大量释放。类似现象也出现在痛风性关节炎中,尿酸盐结晶激活NLRP3炎症小体,引发IL-1β风暴,形成恶性循环。
免疫天平失衡是慢性炎症的核心特征。正常状态下,M1型(促炎)与M2型(抗炎)巨噬细胞维持动态平衡。但在类风湿关节炎患者中,M1型极化过度增强,其分泌的TNF-α浓度可达健康人的5-8倍,而修复型M2细胞数量减少60%以上。这种失衡在糖尿病并发症中同样显著,高血糖环境持续激活JNK2通路,导致心肌和肾脏的炎性损伤。
分子靶点的异常激活构成疾病进展的推手。MD2蛋白作为内源性危险信号传感器,在接触饱和脂肪酸后会触发级联炎症反应,这种机制在糖尿病心肌病中尤为突出。最新研究还发现,细胞器间的膜接触位点(MCS)调控着脂质代谢,其异常与肿瘤微环境中的炎症浸润密切相关。
二、精准医学带来的治疗革命
代谢通路调控成为干预新方向。针对糖酵解关键酶PGK1的抑制剂可将巨噬细胞乳酸产量降低70%,动物实验显示关节炎症状减轻50%。在痛风治疗中,选择性抑制TXNIP/NLRP3通路的新型药物Selnoflast,能使关节红肿消退时间缩短至传统药物的1/3。
免疫细胞功能重塑技术取得突破。利用CRISPR编辑的CAR-T细胞CTX112,在临床试验中成功纠正Treg/Th17细胞失衡,系统性红斑狼疮患者症状缓解率达65%。针对巨噬细胞极化的双功能纳米颗粒NM@NP-Bex,通过递送贝沙罗汀同时抑制Pim2和激活RXR受体,使关节滑膜炎症评分下降40%。
智能药物递送系统提升治疗效果。中性粒细胞膜包裹的纳米载体可精准聚集在炎症部位,将药物浓度提高8-10倍的全身毒性反应降低90%。这种技术已应用于糖尿病肾病治疗,靶向MD2的X22化合物在肾组织蓄积量达血液浓度的20倍。
三、个体化综合管理策略
症状识别与应急处理:
阶梯式治疗方案:
1. 基础干预:低升糖指数饮食(GI<55)配合ω-3脂肪酸(2g/日),可使炎症因子IL-6下降25%
2. 靶向治疗:根据基因检测选择药物,HLA-B5801阳性者禁用别嘌醇,优先选择非布司他
3. 生物制剂:IL-17抑制剂对银屑病关节炎皮损清除率达75%,但需定期筛查结核感染
预防性措施:
四、未来诊疗方向展望
新型检测技术如单细胞测序可解析炎症微环境中特定细胞亚群的变化,指导精准用药。AI辅助诊断系统通过分析关节超声影像,对早期类风湿关节炎的识别准确率达92%。在药物研发领域,双靶点抑制剂同时阻断IL-1β和TNF-α的信号通路,临床前研究显示抗炎效果提升3倍。
当出现无法缓解的持续性疼痛、夜间盗汗伴体重减轻或药物治疗后指标持续异常时,务必在72小时内就医。记住,炎症治疗已进入精准调控时代,通过医患共同决策制定个性化方案,70%以上的慢性炎症患者可实现临床缓解。
