多囊卵巢综合征(PCOS)是育龄期女性最常见的内分泌疾病之一,影响着全球约5%-15%女性的健康与生活质量。许多患者因月经不规律、体毛增多、痤疮反复发作甚至不孕等问题就诊时,常被告知“与PCOS有关”,但对其背后的复杂成因却知之甚少。这种疾病不仅是生殖系统的异常,更是代谢、内分泌甚至遗传因素交织作用的结果。
一、激素失衡:PCOS的核心驱动因素

激素系统的紊乱是PCOS最显著的特征,表现为高雄激素血症、胰岛素抵抗和促性腺激素比例失调的三联征。
1. 高雄激素的恶性循环
PCOS患者卵巢和肾上腺分泌的雄激素(如睾酮)显著升高,导致多毛、痤疮和脱发等典型症状。研究发现,高雄激素不仅抑制卵泡成熟,还会刺激卵巢基质细胞增生,形成“卵泡发育停滞→雄激素持续分泌”的恶性循环。更值得关注的是,高雄激素状态可能始于胚胎期:动物实验表明,孕期暴露于过量雄激素的雌性后代,成年后更易出现卵巢多囊样改变和代谢异常。
2. 胰岛素抵抗的代谢陷阱
约50%-70%的PCOS患者存在胰岛素抵抗。当机体对胰岛素敏感性降低时,会代偿性分泌更多胰岛素,形成高胰岛素血症。这种状态直接刺激卵巢分泌雄激素,并抑制肝脏合成性激素结合球蛋白(SHBG),导致游离睾酮水平进一步升高。值得注意的是,肥胖会加剧这一过程:脂肪组织释放的炎性因子(如TNF-α、IL-6)不仅加重胰岛素抵抗,还与高雄激素形成双向促进作用。
3. 促性腺激素的失衡
下丘脑-垂体-卵巢轴的功能异常导致促黄体生成素(LH)水平升高,而卵泡刺激素(FSH)水平相对不足。LH持续刺激卵巢间质细胞产生雄激素,而FSH不足则使卵泡无法正常发育成熟,最终形成多囊卵巢的超声特征。
二、遗传因素:藏在DNA里的风险密码
PCOS具有显著的家族聚集性,患者一级亲属患病风险较普通人群增加5-6倍。全基因组关联研究(GWAS)已发现多个相关基因位点:
值得注意的是,这些基因变异并非单独致病,而是通过“微效多基因”模式叠加作用,这也解释了PCOS临床表现的高度异质性。
三、生活方式:点燃疾病的“环境”
遗传易感性需要环境因素的触发才能最终导致疾病发生。以下生活方式因素已被证实与PCOS发病密切相关:
1. 能量过剩与肥胖
高糖高脂饮食导致的肥胖,是PCOS最重要的可逆危险因素。脂肪组织不仅是能量储存器官,更是活跃的内分泌器官:
临床数据显示,减重5%-10%即可显著改善排卵功能,降低雄激素水平。
2. 环境内分泌干扰物
双酚A(BPA)、邻苯二甲酸盐等化学物质广泛存在于塑料制品、化妆品中。这些“环境激素”可模拟体内雌激素作用,干扰下丘脑-垂体-卵巢轴功能。研究发现,PCOS患者尿液中BPA代谢物浓度显著高于健康人群。
3. 昼夜节律紊乱
长期熬夜、倒班工作等导致的生物钟失调,可能通过以下途径诱发PCOS:
四、诊断与干预:打破恶性循环的关键
诊断标准(满足以下3项中2项):
1. 排卵障碍(月经稀发或闭经)
2. 高雄激素血症或临床表现(多毛、痤疮)
3. 超声显示卵巢多囊样改变(单侧卵泡≥12个,直径2-9mm)
阶梯式干预策略:
1. 生活方式重塑(一线治疗)
2. 药物对症治疗
3. 代谢手术(BMI≥32.5kg/m²患者)
袖状胃切除术等减重手术可使83%的肥胖型PCOS患者恢复规律月经,妊娠率提高3倍
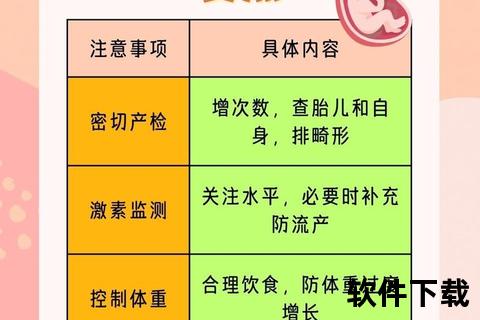
五、特殊人群管理要点
PCOS的成因如同一张交织的网,遗传因素赋予发病倾向,不良生活方式则激活这种潜在风险。理解这种“基因-环境”交互作用模式,有助于制定个性化干预策略。对于患者而言,早期诊断配合生活方式干预,不仅能改善生殖结局,更能显著降低远期代谢并发症风险。当出现月经周期紊乱超过3个月、体毛异常增多或备孕1年未成功时,建议及时至生殖内分泌专科就诊,通过激素检测和超声评估明确诊断。
